胆囊癌(GBC)早期诊断困难,常与良性病变(GBBL)混淆,导致误诊和过度治疗。为了解决这一难题,上海交通大学联合全国11家医疗中心,开发了全球首个多模态AI诊断模型,这一突破性工具被命名为GBCseeker。

该研究整合了循环游离DNA(cfDNA)的基因特征、影像组学和临床数据,开发出能准确识别胆囊癌的AI模型。结果表明,该模型在内部验证中的准确率达93.33%,在外部多中心测试中的准确率为87.76%,并显著降低了56.24%的临床误诊率。
在临床应用方面,该模型创新性地将患者分为三类风险等级,不仅指导手术方案,还为胆囊占位病变的精准诊疗提供了全新工具。
多模态模型的创新构建
研究团队利用cfDNA突变特征,采用逻辑回归、随机森林、支持向量机和极限梯度提升基模型,构建了一个cfDNA诊断模型,并通过综合线性模型来预测GBC和GBBL患者。该模型的AUC值为0.92,灵敏度达到85.71%,特异性达73.68%。结果表明,cfDNA浓度和TP53基因突变是区分良性和恶性胆囊病变的关键指标。图Figure3展示了构建cfDNA诊断模型的流程,包括Logistic回归、随机森林、支持向量机和极限梯度提升,并通过ROC曲线和SHAP值评价各特征的重要性。图3A显示了最重要的30个基因特征,图3E揭示了cfDNA浓度和TP53基因突变在区分GBC与GBBL患者中的关键作用。
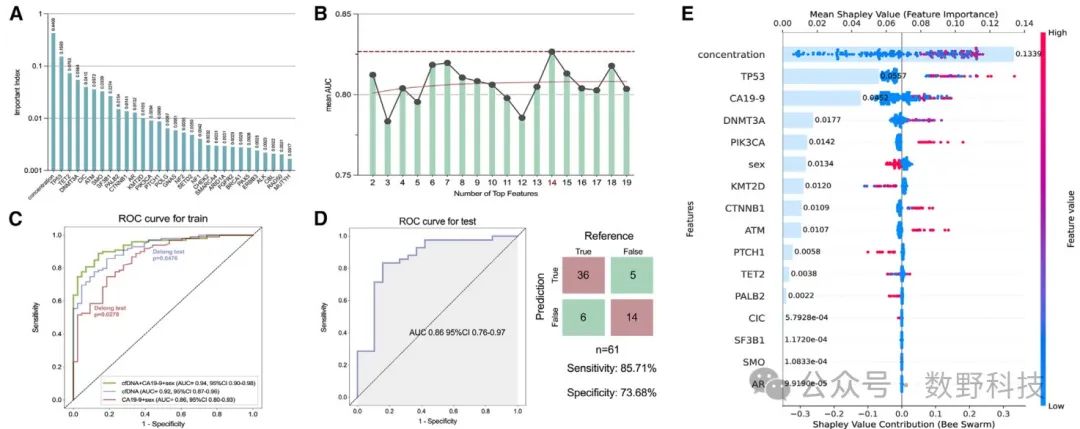
原文 Figure 3
为了进一步提升诊断准确性,研究团队开发了影像组学模型,该模型通过分割42,484张CT图像提取出219个影像特征,并应用bootstrapping森林算法来提升其诊断能力。结果表明,影像模型在特异性方面优于cfDNA模型,特异性达84.21%。通过将cfDNA模型与影像模型整合,形成多模态诊断模型GBCseeker,其在训练集和测试集中的AUC值分别达到0.98和0.97。
在独立验证过程中,GBCseeker在98例患者中的表现依旧稳健,其AUC值达到0.93,对早期GBC(AJCC 0-I期)的检出敏感性提升至78.95%,显著超过原临床诊断敏感性。特别是在壁增厚型病变中,模型的表现尤为突出,其AUC达到0.93,有效解决了传统影像学对胆囊腺肌症等良恶性鉴别的挑战。
总之,GBCseeker的推出为临床诊断提供了强大的工具,显著提升了胆囊癌术前鉴别的准确性。未来,该模型有望通过整合DNA甲基化、代谢组学等新维度,继续提升早期筛查能力。在国际多中心数据的基础上,GBCseeker不仅减少了医疗资源浪费,也有望将早期GBC患者的五年生存率提升20%以上。
模型验证与性能突破
在包含200例患者的验证中,GBCseeker保持了一贯的高准确率。特别是在早期胆囊癌(AJCC 0-I期)的检测中,其敏感性显著提高至78.95%(原临床诊断为57.8%),显示出其在检测早期病变中的突出优势。
GBCseeker在壁增厚型病变中的表现也尤为突出,其AUC达到了0.93,比单独的cfDNA模型和影像模型均有显著提升。在传统的诊断方法里,这类病变通常较为难以区分,但GBCseeker通过多模态数据整合,提供了更精准的诊断。
GBCseeker通过决策曲线分析(DCA)展示了其在所有临床阈值概率范围内的净临床效益均高于单一模式模型,对于不同的病理亚型也表现出一致的高效性。这为临床医生在手术决策中提供了一个可靠的辅助工具,尤其是在早期和复杂病例中,其准确性显著提高。
总之,GBCseeker在独立外部验证中表现出色,其在早期胆囊癌和壁增厚型病变中的诊断优势尤为突出,为临床决策提供了有力的支持。这一模型的高准确性和敏感性显著提升了诊断效率,降低了误诊和漏诊的风险,成为胆囊癌精准诊断的重要工具。
临床转化效果显著
在临床转化方面,GBCseeker通过设定双风险阈值(0.45和0.70)将患者分为低、中、高风险组,从而优化胆囊占位病变的术前诊断和手术决策。低风险组患者(GBCseeker评分<0.45)建议进行简单的腹腔镜胆囊切除而非根治性手术;高风险组患者(GBCseeker评分>0.70)则建议直接进行根治性手术。中风险组患者(GBCseeker评分在0.45至0.70之间)则需要在手术中进行冷冻活检以辅助决策。
应用GBCseeker后,良性病变的过度手术率从25.8%降至8.25%,显著优化了手术方案决策。这意味着大多数(91.75%)的良性病变患者能够避免不必要的根治性手术,而正确分类的恶性病变患者(95.50%)在一次手术中就接受了恰当的治疗方案,有效减少了二次手术的需要。
通过对297例患者的完整数据集分析,采用mGBCseeker风险评分显著提高了诊断准确性,使诊断错误率从原来的9.43%降至5.72%。尤其对于可切除胆囊癌(GBC)患者,该模型在手术方案分配上表现出93.85%的准确率,使得这些患者能够成功接受最佳手术方案,而仅有6.15%分配错误。
值得一提的是,网站https://apps.hpc.sjtu.edu.cn/GBCseeker/prediction提供了mGBCseeker模型的公共访问接口,帮助临床医生在术前诊断和手术过程中更好地分类胆囊占位病变患者。该网站简化了诊断流程,使得基层医院也能利用这一先进工具,优化医疗资源配置。
结语
GBCseeker的问世不仅解决了胆囊癌与良性病变混淆的难题,还开创了AI多模态诊断的新范式。通过融合cfDNA基因突变、影像组学和临床数据,该模型在真实世界中实现了87.76%的准确率,使56.24%的误诊病例避免了错误手术。模型独创的三级风险分层系统,让89%的良性患者避免不必要的根治性切除,同时为95.5%的恶性病例精准匹配手术方案——或许这正是未来外科决策的黄金标准。
更令人振奋的是,研究团队已将这一突破转化为触手可及的临床工具(https://apps.hpc.sjtu.edu.cn/GBCseeker)。当基层医生面对复杂病例时,只需上传CT影像和血液样本,AI系统就能在10分钟内生成风险评估。这种『云端诊断大脑』或将重塑肝胆肿瘤的诊疗格局,特别是在医疗资源分布不均的地区,让顶级三甲医院的技术普惠每个角落。
展望未来,团队正着手整合DNA甲基化标记物和代谢指纹图谱,试图将早期诊断灵敏度突破90%大关。试想:当AI不仅能识别现有癌症,还能预判癌前病变的转化风险——这不正是我们梦寐以求的「防癌于未然」吗?或许在不久后,胆囊癌的五年生存率将不再是冰冷的5%,而是一个可以被技术改写的故事。
参考
[1] Multimodal integration of liquid biopsy and radiology for the noninvasive diagnosis of gallbladder cancer and benign disorders. doi.org/10.1016/j.ccell.2025.02.011
